- La corrupción.
- El soborno.
- La fabricación de fármacos y vacunas que hayan provocado enfermedades muy graves, lesiones de por vida irreversibles, incluso la muerte en personas, adolescentes y niños.
- La mala praxis en sus fabricados y en la concesión de licencias y patentes.
- Irregularidades de todo tipo.
CRISIS DE OPIOIDES EN EE:UU. EL BOOM DE LA HEROÍNA. Artículo de mi blog en 2018. Pincha para ampliar la noticia.
PARDUE PHARMA, DISTRIBUIDORAS, Y MÉDICOS QUE PRESCRIBIERON LA HEROINA, ANTE LOS TRIBUNALES DE EE.UU
En este trágico balance de horror y muerte, sus responsables ha salido absueltos penalmente, incluidos los médicos que los prescribieron a cambio de comisiones por cada receta, aun conociendo la devastación de adicción que acarrearía a sus pacientes.
https://www.consalud.es/mail/stats/compute/click?_d=eyJfciI6Imh0dHBzOlwvXC93d3cuY29uc2FsdWQuZXNcL2Vjc2FsdWRcL2ludGVybmFjaW9uYWxcL2VzY2FuZGFsb3NhLWhpc3RvcmlhLXNhY2tsZXItZmFtaWxpYS1kZXNhdG8tYWRpY2Npb24tb3BpYWNlb3NfMTAyOTg4XzEwMi5odG1sIiwiX2NpZCI6IjYxNWI1ZDk2MzFjM2MiLCJfZSI6InJhcmFhdmlzbHVpc2E0OEBnbWFpbC5jb20iLCJfZXh0IjoiaHR0cHM6XC9cL3d3dy5jb25zYWx1ZC5lc1wvZWNzYWx1ZFwvaW50ZXJuYWNpb25hbFwvZXNjYW5kYWxvc2EtaGlzdG9yaWEtc2Fja2xlci1mYW1pbGlhLWRlc2F0by1hZGljY2lvbi1vcGlhY2Vvc18xMDI5ODhfMTAyLmh0bWwifQ%3D%3D
https://www.elperiodico.com/es/internacional/20211005/escandalo-pederastia-iglesia-catolica-francia-12153148
CASO 2 / 31.05.2021
EL FRAUDE DE LA GRIPE AVIAR REGALÓ 98 MILLONES A LAS FARMACÉUTICAS EL NEGOCIO DEL MIEDO- Todos los partidos políticos sin excepción.
- Las Consejerías de Salud de todas las comunidades, que firmaron los protocolos de la vergüenza de las residencias y que originó la muerte de 30.000 ancianos.
- Los Gerentes de las Residencias públicas y concertadas explotadas por Fondos buitres.
- Los Colegios de Médicos.
- Los Centros hospitalarios.
- Los responsables de la enseñanza , profesores de colegios e institutos que han seguido sus normas a rajatabla con los menores y los jóvenes.
- Los jueces que han desestimado el 98 por ciento de las denuncias de las familias que han presentado demandas judiciales contra esas muertes.
- Todos los medios de comunicación, tanto de derechas como de izquierdas.
- Y finalmente la Iglesia, a través de su más alta Jerarquía, El Papa Francisco que también forma parte implícita y directa de la Agenda 2030 que ya están ejecutando.
CASO 3 / 2.06. 2021
VARIOS ESTADOS DE EE.UU DEMANDARON A GRANDES FARMACÉUTICAS POR CONSPIRAR PARA INFLAR ARTIFICIALMENTE LOS PRECIOS DE LOS MEDICAMENTOS COMUNES.
La noticia fue difundida por BBC New Mundo a mediados del 2019, pero la prensa lo silenció, como ya es habitual en estos casos.
"Tenemos correos electrónicos, mensajes de texto, registros de llamadas y testimonios de exempleados que creemos probarán que hubo una conspiración de años para acordar los precios y fragmentar el mercado para un elevado número de medicinas genéricas".
De acuerdo con información publicada por el sitio especializado Fierce Pharma, la investigación realizada por el Departamento de Justicia de Estados Unidos contra Pfizer se originó de una demanda en la que se acusa a la compañía de realizar sobornos al Ministerio de Salud de Irak en octubre del año pasado, esto con el objetivo de importar productos médicos a precios menores, mientras el organismo se encontraba bajo el control de grupos armados.
En ese sentido, la demanda también acusa a Pfizer de obtener contratos lucrativos de parte del Ministerio de Salud de Irak mientras estaba bajo el control de grupos delictivos, lo cual es considerado como una violación a las leyes antiterrorismo de Estados Unidos, por lo cual se trata de un delito mayor.
De igual manera, la investigación afirma que las farmacéuticas AstraZeneca, Roche y Johnson & Johnson también se encuentran bajo investigación de parte de las autoridades, pero hasta el momento sólo Pfizer ha sido acusada por este hecho.
Por su parte, un portavoz de Pfizer declaró que la compañía cooperará con las investigaciones, además de que este escándalo se suma a la reciente acusación que hizo el Presidente Donald Trump contra la farmacéutica por incrementar de manera injustificada el precio de sus medicamentos.
CASO 5/ 8.06.2021
EL SUPREMO CONDENA A PAGAR 2.100 MILLONES A JOHNSON & JOHNSON
Más de 20 mujeres denunciaron a Johnson & Johnson por vender polvos de talco mezclados con amianto y asbesto.
HOHSON & JOHNSON PLANTEA TRASFERIR LAS DEMANDAS DE SUS POLVOS DE TALCO A UNA NUEVA EMPRESA.
LA COMPAÑÍA SOSTIENE QUE SUS PRODUCTOS "SON SEGUROS"
El Director de la prestigiosa revista "The Lancet" reconoce que es muy difícil publicar conocimientos científicos independientes debido a las presiones que reciben de los laboratorios y farmacéuticas.
CASO 7/ 12.08.2021
NINGÚN EXPERTO DE LA FDA VOTÓ PARA APROBAR UN NUEVO MEDICAMENTO PARA EL ALZHIMER, PERO FUE APROBADO
La Administración de Alimentos y Medicamentos (FDA) aprobó recientemente un nuevo medicamento para el Alzheimer a pesar de que su panel de revisión de expertos rechazó los puntos finales fraudulentos que se utilizaron para promover la "eficacia" del medicamento. A pesar de que el panel de tres miembros votó unánimemente en contra del medicamento, la agencia anuló su análisis científico experto y aprobó el nuevo medicamento de todos modos, optando por depender de una medida separada promovida por la propia compañía farmacéutica. En protesta, los tres asesores de la FDA renunciaron a sus cargos, dejando al descubierto un aparente fraude estatal y científico por parte la FDA.
Uno de los hombres que se opuso al nuevo medicamento fue el Dr. Aaron Kesselheim, director del Programa de Regulación, Terapéutica y Derecho del Hospital Brigham and Women's. El dijo que la aprobación del medicamento Adulhelm sienta "un precedente peligroso" sobre el tipo de evidencia que necesitaría una terapia para el Alzheimer para obtener la aprobación de la FDA.
Kesselheim advirtió que la FDA abandonó la ciencia y permitió a la compañía farmacéutica "dar la vuelta y en el último minuto buscar una aprobación acelerada cuando sus criterios de valoración clínicos primarios en sus ensayos no alcanzaban el nivel necesario para la aprobación [tradicional] de la FDA".
El nuevo fármaco promueve una teoría no probada de que los tratamientos con placa amiloide pueden revertir el Alzheimer. Jason Karlawish, geriatra y codirector del Penn Memory Center en Filadelfia, Pensilvania, dice que la hipótesis de la reducción de la placa amiloide se ha estudiado durante décadas, pero ninguna ciencia ha demostrado que estas reducciones mejoren la cognición de los pacientes con Alzheimer.
“La desesperación debería impulsar la financiación de la ciencia, no la forma en que interpretamos la ciencia”, dice Karlawish. A pesar de la controversia, los principales medios de comunicación ya estaban preparados para comercializar el nuevo fármaco, con titulares llenos de esperanza para los pacientes con Alzheimer:
ANTENA 3: Estados Unidos aprueba el primer medicamento para las primeras fases del Alzheimer en 20 años
TELECINCO: Aduhelm: EEUU aprueba el primer medicamento contra el alzheimer en dos décadas
- Astra Zeneca 1,3%
- Moderna 1,2%
- J&J 1,2%
- Pfizer 0,84%
Volviendo al tema del novedoso medicamento contra el Alzheimer; George Perry, neurobiólogo de la Universidad de Texas en San Antonio, dijo: “Esto hará retroceder a la comunidad investigadora entre 10 y 20 años”, porque desalentará a los desarrolladores de medicamentos a centrarse en tratamientos que realmente afectan la cognición de manera profunda.
Los neurólogos argumentan que la demostración de actividad reductora de amiloide no debería ser el estándar de oro para obtener la aprobación regulatoria de nuevos medicamentos para la enfermedad de Alzheimer. Esto es similar a la aprobación de uso de emergencia de la FDA para las vacunas COVID, que se basa en criterios de diagnóstico fraudulentos como, y en correlaciones falsas y al azar, como por ejemplo revelaron recientemente documentos de Pfizer.
Otro miembro del panel de expertos de la FDA, el neurólogo J. Perlmutter, decidió renunciar al comité "debido a esta decisión de la FDA sin discutirlo más con nuestro comité asesor " El neurólogo de Mayo Clinic, David Knopman, hizo lo mismo y entregó a la FDA su carta de renuncia. Dijo que el Aduhelm de Biogen "fue probablemente la peor decisión de aprobación de medicamentos en la historia reciente de Estados Unidos".
Knopman, Perlmutter y Kesselheim se adelantaron a la curva en noviembre pasado, estudiando el fraude de Biogen. Debido a que previamente habían expuesto los resultados fraudulentos del ensayo del fármaco para el Alzheimer y habían publicado un artículo sobre las fallas del fármaco en JAMA , la FDA recusó a Knopman de tener autoridad sobre el asunto. La FDA ahora anula su propio panel científico y ayuda a estas compañías farmacéuticas a comercializar falsamente sus productos.
Aquí la noticia.
CASO 8 / 15/08.2021
ABBOT PAGARÁ DE 100 MILLONES POR SOBORNOS Y RECLAMACIONES FALSAS DE DIABETES A MEDICARE
Abbott compró Alere por 4.500 millones de dólares (3.787,3 millones de euros) en octubre de 2017.COAPROVEL
| Nombre y peso | Número de lote | Fecha de caducidad |
|---|---|---|
| Nombre y peso | Número de lote | Fecha de caducidad |
|---|---|---|
IBERSARTAN
Nombre y peso. Número de lote. Fecha de caducidadTodas las alertas son de "Clase 2". Tal y como indica la AEMPS, existen tres clases de alerta: 1, 2 y 3. La Clase 1 corresponde al riesgo más elevado, mientras que la Clase 3 es la menos peligrosa. Por lo tanto, esta alerta es de un riesgo medio.
Si tiene alguno de los lotes en su casa, acuda a la farmacia para entregarlos.
CASO 10/ 15.08.2021
EL FÁRMACO PARA LA ARTRITIS DE PZIFER, INVESTIGADO POR RIESGO DE EFECTOS SECUNDARIOS GRAVES, INCLUIDO EL CÁNCER.CASO 11 / 15.08.2021
MULTA A PFICER POR SUBIR INJUSTAMENTE EL PRECIO DE LA PASTILLAS PARA LA EPILEPSIA .CASO 12/ 15.08.2021
LOS 16 FÁRMACOS RETIRADOS POR SANIDAD POR DETECTAR UN POSIBLE CARCINÓGENO. |
| Zantac, uno de los medicamentos retirados |
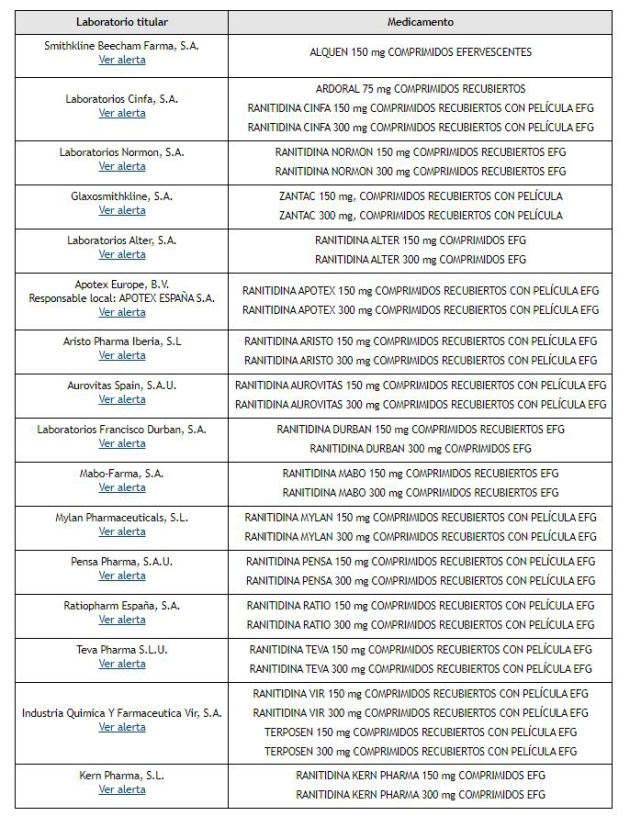
MEDICAMENTOS RETIRADOS:
- ALQUEN 150 mg COMPRIMIDOS EFERVESCENTES
- ARDORAL 75 mg COMPRIMIDOS RECUBIERTOS
- RANITIDINA CINFA 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA CINFA 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA NORMON 150 mg COMPRIMIDOS RECUBIERTOS EFG
- RANITIDINA NORMON 300 mg COMPRIMIDOS RECUBIERTOS EFG
- ZANTAC 150 mg, COMPRIMIDOS RECUBIERTOS CON PELÍCULA
- ZANTAC 300 mg, COMPRIMIDOS RECUBIERTOS CON PELÍCULA
- RANITIDINA ALTER 150 mg COMPRIMIDOS EFG
- RANITIDINA ALTER 300 mg COMPRIMIDOS EFG
- RANITIDINA APOTEX 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA APOTEX 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA ARISTO 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA ARISTO 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA AUROVITAS 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA AUROVITAS 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA DURBAN 150 mg COMPRIMIDOS RECUBIERTOS EFG
- RANITIDINA DURBAN 300 mg COMPRIMIDOS EFG
- RANITIDINA MABO 150 mg COMPRIMIDOS RECUBIERTOS EFG
- RANITIDINA MABO 300 mg COMPRIMIDOS RECUBIERTOS EFG
- RANITIDINA MYLAN 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA MYLAN 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA PENSA 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA PENSA 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA RATIO 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA RATIO 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA TEVA 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA TEVA 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA VIR 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA VIR 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- TERPOSEN 150 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- TERPOSEN 300 mg COMPRIMIDOS RECUBIERTOS CON PELÍCULA EFG
- RANITIDINA KERN PHARMA 150 mg COMPRIMIDOS EFG
- RANITIDINA KERN PHARMA 300 mg COMPRIMIDOS EFG
LOS CRÍMENES DE LAS GRANDES COMPAÑÍAS FARMACÉUTICAS. Estudio de Investigación de Teresa Forcades
Documento de la monja Teresa Forcades sobre los címenes de las Farmacéuticas.
Os detallo una primera parte del estudio de Teresa Forcade: " LOS CRÍMENES DE LAS FARMACÉUTICAS. Si queréis ampliar toda información hasta el final, la encontraréis en el enlace.
Teresa Forcades i Vila es monja benedictina. Doctora en medicina, prepara un doctorado en teología. Perteneció al primer grupo de jóvenes de Cristianisme i Justícia.
 |
| Teresa Forcades |
- ¿Cuáles son esas actuaciones?
- ¿Quién recibe sus consecuencias?
- ¿Qué mueve a las compañías farmacéuticas a actuar de tal forma?
- ¿Qué respuestas están teniendo lugar ante esos abusos y cuáles deben producirse aún?
EL CASO DE LA “DISFUNCIÓN SEXUAL FEMENINA. Estudio de Teresa Forcades
” En el año 1998, la empresa Pfizer, la principal compañía farmacéutica de EEUU, comercializó un medicamento conocido con el nombre de “Viagra” para el tratamiento de la disfunción sexual masculina (concebida como disminución o desaparición de la capacidad de erección). Tres años más tarde, a 17 millones de hombres del mundo entero les había sido recetado dicho medicamento y su volumen de ventas en un solo año (2001) superaba los mil quinientos millones de dólares2. Con este nuevo producto, Pfizer había superado largamente los criterios de definición de un “blockbuster”, que es el nombre con que se conoce en el argot de las farmacéuticas un medicamento con un volumen de ventas anual superior a los mil millones de dólares (o de euros). Los directivos de Pfizer se preguntaron: “¿Y si fuera posible conseguir un éxito semejante con un producto similar dedicado a las mujeres?”. El problema era que si bien existía un criterio aparentemente claro para hablar de “disfunción” en el caso de la sexualidad masculina (las dificultades en la erección), en el caso de las mujeres esto era mucho más difícil de definir y, sobre todo, de cuantificar o evaluar objetivamente.
En el año 1997, pocos meses antes de que Viagra apareciera en el mercado, ya había tenido lugar en Cape Cod (Nueva York) el primer encuentro de especialistas médicos para determinar el perfil clínico de la “disfunción sexual femenina”. La iniciativa, organización y financiación del encuentro corrieron a cargo de 9 compañías farmacéuticas muy preocupadas por el hecho de que no existiera una definición de este trastorno compatible con un potencial tratamiento farmacológico. Los promotores de tal encuentro eligieron entre sus colaboradores directos las personas que debían asistir al mismo.
El objetivo de la reunión era diseñar la estrategia adecuada para crear una nueva patología en función de los intereses económicos de la industria farmacéutica. Un año y medio más tarde, en octubre de 1998, se celebró en Boston la primera conferencia internacional para la elaboración de un consenso clínico sobre la disfunción sexual femenina. 8 compañías farmacéuticas financiaron esta conferencia y 18 de los 19 autores de la nueva definición “consensuada internacionalmente” admitieron tener intereses económicos directos con estas u otras compañías. Un año más tarde, en 1999, apareció un artículo en la revista JAMA titulado “Disfunción sexual en EEUU: prevalencia y variables predictivas”, en el que se afirmaba, supuestamente con objetividad científica, que un 43% de la población femenina de EEUU sufría la “nueva enfermedad” definida según los intereses de la industria farmacéutica. Los pasos seguidos para identificar a la “población enferma” fueron los siguientes:
- 1) se elaboró una lista de 7 “problemas” considerados cada uno de ellos de suficiente peso como para justificar el diagnóstico de la nueva enfermedad si una mujer los había presentado durante dos meses o más en el último año.
- 2) se pasó el cuestionario a una muestra de 1.500 mujeres.
- 3) se evaluaron los resultados de forma que responder “Sí” a uno solo de los ítems se consideró criterio suficiente para identificar la enfermedad.
Los editores de la revista recibieron en 6 semanas un total de 70 respuestas y comentarios con relación al artículo de Moynihan. 2/3 de las respuestas fueron de apoyo y confirmaron la indignación de los profesionales de la medicina ante dicha manipulación aunque, como deja bien claro una de las respuestas, sin ellos no podría producirse. Si los médicos no colaborásemos con los abusos de las compañías farmacéuticas, esos abusos no acontecerían.
EL CASO DE LOS MEDICAMENTOS ANTI-SIDA EN ÁFRICA. Estudio de Teresa Forcades.
La industria india de genéricos daba trabajo en el año 2003 a 500.000 personas en más de 20.000 empresas (que, mediante contratos subsidiarios, daban trabajo a un total de más de 2,5 millones de personas). De acuerdo con la ley de 1970 que en marzo de 2005 fue derogada, los genéricos indios podían ser comercializados en otros países pobres, como la mayoría de países del África subsahariana, donde hoy residen más de 30 de los 40 millones de personas infectadas con el VIH en todo el mundo. Según informes de la ONU del año 2003, más de 30 millones de personas están infectadas con el VIH en el África subsahariana. En el estado de Botswana, por ejemplo, el 40% de las mujeres están infectadas por VIH, y en el de Lesotho lo está un tercio del total de la población. Por falta de medicamentos antirretrovirales, tres millones de africanos mueren todos los años de SIDA.
La industria farmacéutica india de genéricos ha sido hasta el momento fundamental para asegurar el acceso a los medicamentos a un porcentaje ínfimo (menos del 1%) pero creciente de la población de los países pobres, especialmente el acceso a los medicamentos antirretrovirales necesarios para tratar la infección por VIH. Gracias a esta libre competencia que eliminaba el sistema de patentes, el precio del tratamiento antirretroviral se había reducido en el año 2004 de 1.500 a 150 dólares por persona y año. Además, dado que no tenían que respetarse las patentes que obligan a producir cada medicamento por separado, los laboratorios indios podían combinar los tratamientos múltiples en una sola pastilla. La reducción del coste y la simplificación del tratamiento que supone la combinación de tres principios activos diferentes en una única pastilla han tenido efectos dramáticos en la posibilidad de tratar con éxito la epidemia de SIDA.
A escala mundial, unas 350.000 personas en tratamiento antirretroviral dependen de la producción de genéricos en India. Este número representa la mitad de la totalidad que toma tratamiento antirretroviral en los países en vías de desarrollo. Ello significa que menos de un 2,5% de los seropositivos por VIH reciben tratamiento en los países en vías de desarrollo. Millones de personas mueren todos los años a causa de ello. Con el reforzamiento internacional del sistema de patentes, todos los medicamentos creados entre 1995 y 2005 más todos los que se creen a partir de 2005, estarán protegidos por la patente y no entrarán en competencia libre, con lo que su precio puede encarecerse más de 10 veces (como mínimo). Y esto, en cuanto a los medicamentos esenciales para tratar la infección de VIH, otras infecciones muy prevalentes y potencialmente mortales (como la malaria o la tuberculosis) o el cáncer.
Entre 1995 y 2005 ha habido en India 8.926 demandas de patentes que, debido a la nueva ley impuesta por la OMC, ahora deberán ser revisadas. De estas casi 9.000 patentes, más de 7.000 proceden de multinacionales extranjeras, con el gigante farmacéutico Pfizer al frente. Pfizer es hoy la mayor compañía farmacéutica del mundo, y uno de los principales agentes económicos en EEUU.
Pfizer doblegó al gobierno francés en 2002 con la amenaza de retirarse de Francia si sus demandas no eran atendidas, es decir, si el gobierno francés ponía pegas a sus precios claramente abusivos; el gobierno francés cedió y no hubo escándalo.
Si un estado de la Unión Europea como Francia tuvo que ceder a sus demandas, ¿con qué fuerza política podrían oponerse a la imposición de pactos bilaterales desventajosos los países en vías de desarrollo?
La relación directa entre la imposición de una patente y la mortalidad de la población puede ejemplificarse con el caso de Brasil. En Brasil, desde que se votaron leyes que prohíben patentar los medicamentos aparecidos en el mercado brasileño antes de 1997, pudieron producirse localmente equivalentes genéricos de 8 de los 12 antirretrovirales disponibles mundialmente con una reducción de promedio del coste del 79%. En el año 2003 se constató que se había estabilizado la epidemia y se había reducido la mortalidad a la mitad. Con la nueva legislación internacional la producción de genéricos de Brasil también quedará bloqueada.
Por su interés, reproduciremos a continuación algunos extractos de la carta que Karim Laouabdia, portavoz de la campaña para el acceso a las medicinas esenciales de Médicos sin Fronteras (MSF), dirigió el 20 de septiembre de 2005 a Pascal Lamy con motivo de su elección como director general de la Organización Mundial del Comercio (OMC):
“La crisis VIH/SIDA ha evidenciado la necesidad urgente de asegurar que los medicamentos esenciales estén disponibles a precios asequibles. Hoy, aproximadamente la mitad del millón de personas que reciben tratamiento antirretroviral en los países en vías de desarrollo dependen de la industria de genéricos. Las dosis combinadas que se producen en India simplifican enormemente la administración del tratamiento antirretroviral y han jugado en papel crítico en hacer llegar el tratamiento a las áreas de escasos recursos. La Declaración de Doha de la OMC del año 200117 representó un paso fundamental para aumentar el acceso a los medicamentos. Esta declaración apoya de forma clara a cualquier gobierno en la tarea de proteger la salud de su población utilizando las brechas legislativas del ADPIC para superar las barreras impuestas por el sistema de patentes, y ayuda a los países menos desarrollados extendiendo el periodo de transición libre de patentes hasta el año 2016.
Desde entonces, sin embargo, hemos asistido al desmantelamiento sistemático de la Declaración de Doha mediante acuerdos comerciales bilaterales que imponen niveles de protección de la propiedad intelectual mucho más elevados que los exigidos por la OMC. El impacto de la protección de patentes en los programas del VIH será muy evidente en los próximos años, en los que un número muy elevado de pacientes que se encuentran hoy en tratamiento se verán obligados a sustituir su actual tratamiento por medicamentos más nuevos, de segunda línea. Estos medicamentos son de promedio de 4 a 10 veces más caros que los de primera línea, y casi todos son o serán patentados en países pobres que tendrían la capacidad de producirlos en versión genérica (India, Brasil y Tailandia). (...) Además, el impacto de la nueva legislación de patentes no se limita a los medicamentos antirretrovirales, sino que afectará de forma progresiva a todo el conjunto de enfermedades por lo que refiere a los medicamentos que se desarrollen a partir de ahora. (...) Hasta el momento –y en contra de las promesas realizadas– el aumento de la protección de patentes en los países en vías de desarrollo no ha contribuido al incremento de la investigación.
Muchas enfermedades graves son simplemente ignoradas. Vivimos las consecuencias de ello en nuestro día a día asistencial: cuando se trata de diagnosticar la tuberculosis en personas infectadas por VIH; al tratar enfermedades tropicales como la leishmaniasis, que afecta a 12 millones de personas; en el seguimiento de los infectados con el VIH y en el tratamiento de los niños con VIH...
Menos de 3 meses después de haber expuesto la urgencia de esta situación ante la OMC, Médicos sin Fronteras emitía un comunicado de prensa en el que denunciaba que, además de prohibir la producción de genéricos en los países pobres, las compañías farmacéuticas se negaban a comercializar en dichos países los medicamentos que no les aportaban suficientes beneficios. El ejemplo que ponían era el de la combinación antirretroviral Kaletra de la casa Abbott. La casa Abbott ha comercializado recientemente una versión del Kaletra que no necesita refrigeración. A pesar de la gran utilidad que un preparado así tendría en el contexto africano, debido a las elevadas temperaturas y a la frecuencia con que se interrumpe el suministro eléctrico, la casa Abbott se ha negado a comercializarlo en África. En cuanto a otro de los medicamentos antirretrovirales recomendado por la OMS, el Tenofovir, la casa Gilead, que tiene su patente, tampoco lo ha comercializado en África.
RIQUEZA Y PODER DE LAS GRANDES COMPAÑÍAS FARMACÉUTICAS CONTRA LOS POBRES. ( Estudio de Teresa Forcades )
El extraordinario incremento del poder político y económico de las grandes compañías farmacéuticas estadounidenses se inició con la ley de extensión de patentes (Ley Hatch-Waxman) que la mayoría republicana de la era Reagan aprobó en 1984, y se consolidó con la creación de la Organización Mundial del Comercio (OMC) en 1994, destinada a asegurar que la globalización no atentara contra los intereses del gran capital.
Los márgenes brutos de esta industria son del 70 al 90% y su tasa de ganancias es la más elevada de todas (según la revista Fortune fue, en el año 2000, del 18,6%, versus el 15,8% de los bancos comerciales; la tasa de ganancias de Pfizer, la mayor compañía farmacéutica, fue en el año 2004 del 22% del total de las ventas, que fueron de 53 billones de dólares. Para poder evaluar la potencia económica de una empresa así, puede resultar ilustrativo hacer notar que el total de ingresos impositivos del conjunto del Estado español aquel mismo año –2004– fue de 138 billones de euros y que el total de ingresos derivados de las declaraciones de Renta fue de 32 billones de euros.
LA CARGA IMPOSITIVA PARA LAS FARMACÉUTICAS ES MÍNIMA
A pesar de dichas ganancias billonarias, la carga impositiva de la industria farmacéutica es muy inferior a la media de las empresas (de un 16,2% versus el 27,3% del promedio de la gran industria), mientras que su principal producto (los medicamentos de receta) incrementa de precio muy por encima del nivel de la inflación (de un 6 a un 20% todos los años).
El lobby de las compañías farmacéuticas de EEUU (la PhRMA) contaba en el año 2000 con 297 lobbysters profesionales, es decir, uno por cada dos congresistas. Dicho número –que ya superaba en mucho el de cualquier otro grupo de presión–, ha sido triplicado en los últimos años, de modo que en 2002 la PhRMA financió el trabajo de 675 lobbysters, lo que significa que había, trabajando en Washington, más promotores de los intereses de las compañías farmacéuticas que congresistas. Ello ha hecho posible que esta industria consiguiera las ventajosas condiciones que le han permitido dominar progresivamente el mercado mundial: el 60% de las patentes de medicamentos son de EEUU, versus el 20% de la Unión Europea, y EEUU domina el mercado de los 50 medicamentos más vendidos (todos, blockbusters)
Las exenciones y reducciones de impuestos expuestas más arriba y la multiplicación de leyes y pactos favorables a partir de la era Reagan muestran que la situación actual del desproporcionado privilegio que disfruta la industria farmacéutica no es fruto del “libre mercado” sino de una política deliberada destinada a proteger una industria que en EEUU es tan estratégica como la del petróleo.
LA GANANCIA DE 10 FARMACÉUTICAS FUE DE 35,9 BILLONES DE $
En el año 2002, la suma de las ganancias de las 10 compañías farmacéuticas más importantes superó las ganancias combinadas de las otras 490 empresas que aparecen en la lista de las 500 industrias más provechosas de la revista Fortune.
Las 10 farmacéuticas más importantes, juntas, tuvieron un beneficio total de 35,9 billones de dólares y las restantes 490 empresas, juntas, tuvieron un beneficio total de 33,7 billones de dólares.
La Dra. Marcia Agnell, editora jefe durante casi 20 años de la revista médica de mayor impacto, el New England Journal of Medicine, afirma lacónicamente: “Una industria con tal volumen de ganancias es como un gorila de 500 kg: hace lo que quiere”. Y Philippe Pignarre, directivo durante diecisiete años de una gran compañía farmacéutica y actualmente profesor de la Universidad de París-VIII, insiste en que el mercado no es ni ha sido nunca una realidad “natural” sino “cultural” o “social”, o sea, fruto de reglamentaciones y normas que no regulan una “realidad natural” previa al establecimiento de las normas sino que “hacen posible”, “dan a luz” o “modifican” una realidad intrínsecamente cultural. El mercado siempre tiene normas que lo regulan. El “mercado libre” (libre mercado) no existe; existe, eso sí, el “mercado salvaje”, es decir, el mercado regulado según los intereses del rey de la selva o del gorila de 500 kg, y el “mercado menos salvaje”, en el que las normas intentan temperar la avidez de los más fuertes.
¿CÓMO UTILIZAN LAS FARMACÉUTICAS SU PODER ECONÓMICO? Estudio de Teresa Forcades.
Las grandes compañías farmacéuticas utilizan hoy su riqueza y poder para defender sus propios intereses a costa del bienestar, la salud y la vida de otras personas. De acuerdo con el informe elaborado el año pasado 2005 por la comisión de expertos del Parlamento inglés, los intereses de la industria farmacéutica y los del conjunto de la población no coinciden: esta comisión constató que es “esencial poner en marcha un régimen regulador eficaz que consiga que la industria farmacéutica no perjudique el bien común” y determina que “el objetivo de los nuevos medicamentos debería ser conseguir que los pacientes obtengan un beneficio terapéutico real”. ¿Qué significa este lenguaje? ¿El Parlamento tiene que regular que las compañías farmacéuticas se dediquen a crear medicamentos que sean útiles para los pacientes? Si no producen medicamentos útiles, ¿a qué se dedican hoy por hoy estas compañías? ¿Cómo obtienen los mil millonarios beneficios que hacen que el mismo informe que estamos citando afirme que la industria farmacéutica debe ser considerada “una joya en la corona inglesa” porque es la tercera industria más rentable del país, tras el turismo y la banca ?
¿Cómo consigue sus beneficios esta industria si su principal actividad no es realizar medicamentos útiles?
Las principales estrategias utilizadas hoy por la industria farmacéutica para obtener sus ganancias mil millonarias son las siguientes:
- 1) comercializar y efectuar una extraordinaria presión propagandística de los medicamentos que fabrica, aunque no sean útiles y puedan ser nocivos e incluso mortales;
- 2) explotar al máximo los medicamentos (incluidos los esenciales) en forma de monopolio y en condiciones abusivas que no tienen en cuenta las necesidades objetivas de los enfermos ni su capacidad adquisitiva;
- 3) reducir a la mínima expresión o eliminar totalmente, en algunos casos, la investigación de las enfermedades que afectan principalmente a los pobres, porque no resultan rentables, y concentrarse en los problemas de las poblaciones con un alto poder adquisitivo, aun cuando no se trate de enfermedades (como la proliferación de “medicamentos” antienvejecimiento);
- y 4) forzar las legislaciones nacionales e internacionales a que favorezcan sus intereses, aunque sea a costa de la vida de millones de personas.
En el primer semestre de 2003, el número de suicidios registrado fue de 17. Después de que un bufete de abogados estadounidense hiciera públicos dichos datos y se abriera un registro propio de los citados incidentes, en los 12 meses que van de septiembre de 2003 a agosto de 2004 se documentaron 2.700 intentos de suicidio entre los enfermos que tomaban gabapentina, de los que 200 terminaron con la muerte del enfermo. 2.500 intentos fallidos y 200 muertes en 12 meses.
En noviembre de 2004 la revista British Medical Journal (BMJ) informaba del hecho que, una vez se les habían remitido los datos, ni la compañía Pfizer ni la agencia reguladora FDA habían tomado todavía medida alguna, ni siquiera la de indicar en el prospecto el incremento del riesgo de suicido. En el momento de escribir estas líneas he consultado la página web de la compañía Pfizer. En los advertimientos, Pfizer deja constancia de la posibilidad que el Neurontin incremente el riesgo de suicido, pero para encontrar esta información tienen que leerse 26 páginas de explicaciones farmacológicas y de posibles efectos secundarios.
ZOLOFT ANTIDEPRESIVO
En cuanto al antidepresivo sertralina (Zoloft), también de la casa Pfizer, el mismo BMJ informaba que la compañía había ocultado información sobre los posibles efectos secundarios de intento de suicidio y agresividad.
LOS MEDICAMENTOS INÚTILES
Los medicamentos inútiles se conocen en el argot farmacéutico de “medicamentos yo también” (me-too drugs). Estos medicamentos se diseñan y comercializan con el objetivo de sustituir a un medicamento anterior cuya patente está a punto de expirar. Por lo que refiere a sus propiedades terapéuticas, son esencialmente las mismas que las del medicamento anterior pero, dado que se aprueban como si fueran medicamentos nuevos, la compañía farmacéutica que los fabrica tiene derecho a explotarlos en régimen de monopolio protegido por el derecho de patente durante unos cuantos años.
EL PODER DEL MARKENTING
El éxito de los medicamentos inútiles se explica únicamente por el poder del marketing sobre los médicos y los pacientes.
Un ejemplo de estos medicamentos sería la cerivastatina de la casa Bayer, sus nombres comerciales son Baycol, Lipobay, Cholstat y Staltor, un medicamento anticolesterol que en el año 2001 tuvo que ser retirado del mercado cuando se comprobó que había sido el causante de 1.100 casos de rabdomiolisis severa, una destrucción muscular que puede ser irreversible y originó un centenar de muertes.
Indignación en Francia
El gigante farmacéutico enfrentó gran indignación por parte de las autoridades sanitarias de varios países por la manera en que retiró el medicamento de circulación.
Según informó un diario alemán, se sabía de los riesgos desde 1998.
Seguimos afirmando que el Lipobay o el Baycol sigue siendo un fármaco seguro |
Ignacio Sánchez León, portavoz de Bayer en España |
En Francia, el ministro de Salud, Bernard Kouchner, cuestionó la decisión de la Bayer de notificar a la bolsa de Frankfurt de la retirada mundial de Baycol, antes de informar a los médicos y los pacientes
Imagino que a todos os debe sonar eso que dicen siempre las Farmacéuticas:
"La vacuna contra el Covid es segura". Eso también lo dicen no solo con la vacuna contra el Covid, sino con cada vacuna o medicamento que sacan, aunque hayan acarreado miles de efectos adversos, enfermos y muertes.
VIOX ANTIINFLAMATAORIO
Otro ejemplo aún más reciente es el de los antiinflamatorios Vioxx (de la casa Merck) y Bextra y Celebrex (de Pfizer).
Estos medicamentos no demostraron ningún beneficio objetivo en los ensayos clínicos previos a su comercialización que los comparaba con otros antiinflamatorios ya existentes, pero en 1998 y 1999 recibieron el visto bueno de las agencias reguladores porque se esperaba que tuvieran menores efectos secundarios.
En septiembre de 2004, Vioxx se retiró del mercado después de que se constatara que sus efectos secundarios no sólo no eran menores sino que incluso eran mortales, ataques al corazón y embolias.
La agencia reguladora de los medicamentos en EEUU consideró que Vioxx podía haber sido responsable de 27.785 muertes por ataque al corazón entre 1999 y 2003.
BEXTRA Y CELEBREX
En abril de 2005, Bextra y Celebrex (de Pfizer) se retiraron también del mercado tras unos cuantos meses de estira y afloja con las autoridades sanitarias que pusieron de manifiesto la gran influencia política de estas compañías.
Cuando se desarrolla un nuevo medicamento, siempre existe un riesgo de efectos secundarios no deseados que no han podido detectarse en la fase de estudio. Hay que contar con ello. Pero, entonces, si todo nuevo medicamento tiene un riesgo potencial de causar efectos secundarios serios o incluso la muerte,
- ¿Por qué se desarrollan medicamentos nuevos que no aportan ninguna mejora terapéutica respecto a otros ya existentes?
- ¿Por qué los producen los laboratorios?
- ¿Por qué las agencias reguladoras los aprueban? ¿Por qué los médicos los recetan?
Dentro de este apartado de comercialización injustificada, deben mencionarse por último los medicamentos destinados a curar enfermedades –como la disfunción sexual femenina– que la industria farmacéutica ha creado según sus intereses.
Algunos ejemplos de condiciones de la vida humana etiquetados como “enfermedad” para poder comercializar medicamentos que las sanen serían la menopausia para poder vender tratamientos hormonales sustitutivos que hoy en día han demostrado un inaceptable nivel de efectos secundarios; la tristeza más o menos fisiológica, adaptativa o incluso creativa, que se etiqueta de depresión, para poder vender antidepresivos, que ya hemos visto que pueden causar homicidios y suicidios; y las dificultades de memoria propias de la gente mayor que se etiquetan como “déficit cognitivo incipiente” para poder vender medicamentos antidemencia al saber que sufren demencia los ancianos se deprimen y entonces, además del medicamento antidemencia, puede vendérseles un antidepresivo. En inglés tienen una expresión popular para denunciar esta penetración abusiva del modelo médico en ámbitos de la vida que no le son propios; dicen: “a pill for every ill”.
El informe 2005 de la comisión de expertos del Parlamento inglés constata que en 2003 se vendieron en Inglaterra 650 millones de medicamentos de receta, o sea, sin tener en cuenta todos los medicamentos que pueden adquirirse directamente en la farmacia sin que los recete un médico. Este número refleja un incremento del 40% respecto a los medicamentos vendidos 10 años antes y significa que cada ciudadano inglés toma una media de 13,1 medicamentos de receta al año.
Este mismo informe especifica que “está claro que no puede acusarse en solitario a la industria farmacéutica del problema de la medicalización de la sociedad, pero dicha industria ha exacerbado el problema estimulando una confianza enfermiza en el uso de los medicamentos; la tendencia actual es catalogar cada vez más y más individuos como 'anormales' y necesitados de tratamiento farmacológico”.
Según la red de centros regionales de farmacovigilancia de Francia, todos los años, 1.300.000 franceses son hospitalizados en el sector público por efectos indeseables de un medicamento. Este número es el 10% del total de las hospitalizaciones. De estas personas, una tercera parte se encuentran en estado grave y 18.000 mueren cada año, el doble del número de muertes por accidentes de carretera.
EXPLOTACIÓN DE MEDICAMENTOS ESENCIALES EN CONDICIONES ABUSIVAS. Estudio de Teresa Forcades.
Al discutir la comercialización de los antirretrovirales en África, hemos visto el brutal impacto que la nueva legislación sobre patentes, en vigor en 2005, tiene sobre el acceso a los medicamentos esenciales en los países pobres. Pignarre caracteriza así la respuesta de las grandes compañías farmacéuticas a las denuncias que les llegan de las organizaciones humanitarias: “La industria farmacéutica explica que todo ataque al derecho de patentes en el Tercer Mundo, y en particular en África, con relación a los medicamentos contra el SIDA, significará el final de unas investigaciones que ya nadie querrá financiar. (...) No obstante, si se sigue dicho razonamiento, el progreso no podría continuar sin el precio de millones de vidas humanas que habitan en el Tercer Mundo, y ello teniendo en cuenta que este progreso del que se habla es sólo una promesa… Incluso si fuera una promesa plausible, se trataría de optar por prolongar la duración y la calidad de vida de las poblaciones privilegiadas del Norte a costa de acortar de forma inmediata, en decenas de años, la esperanza de vida en el Sur. ¡Lo que equivale a condenar al 90% de quienes tienen necesidad de medicamentos para seguir viviendo, para que los precios sigan siendo elevados para el 10% de los privilegiados!
Esta dialéctica obscena en la que, de modo unánime, quiere encerrarnos la industria farmacéutica de los países ricos, es el inicio de un reinado de terror”. En plena polémica sobre la obligatoriedad impuesta a los países pobres de respetar las abusivas patentes de los antirretrovirales a costa de la vida de sus ciudadanos, la Oficina Mundial de la Propiedad Intelectual (OMPI) –que forma parte de la ONU– elaboró un documento de propaganda a favor de las compañías farmacéuticas en el que tachaban de “mitos” y se refutaban con argumentos falsos las seis acusaciones principales contra el sistema de patentes. Reproducimos en versión resumida la formulación que hizo la OMPI de tales “mitos” y algunos de los comentarios que hace sobre ello Ph. Pignarre:
Las dificultades de acceso a la atención sanitaria y de disponibilidad de medicamentos esenciales son consecuencia del sistema de patentes. Si ello es un mito, ¿por qué los países que no respetaron el sistema de patentes (como India) han podido actuar mucho mejor contra el SIDA que los países que, por las buenas o por las malas, tuvieron que aceptarlos? El coste elevado de los medicamentos es principalmente una consecuencia del sistema de patentes que permite que los industriales fijen precios artificialmente elevados. Si ello es un mito, ¿por qué el fluconazol, un medicamento utilizado en enfermos de SIDA, tiene un precio de mercado que varía entre 14 y 25 euros en los países donde Pfizer ha mantenido su monopolio y de sólo 0,75 euros en los países donde existen genéricos? ¿Por qué la compañía india de genéricos Cipla propone a MSF un coste anual de la triterapia antisida de 350 euros por paciente contra los 10.400 euros exigidos por los laboratorios occidentales?
El sistema de patentes favorece los intereses de los industriales a expensas del bien común. A la práctica existe contradicción entre los intereses de los industriales y el bien común. El mercado en general – muy particularmente el mercado de los medicamentos– no es libre; está sometido a regulación en todos los países. Actualmente, esta regulación favorece a los industriales. Como recomienda el comité de expertos del Parlamento inglés, deberían modificarse las normas en favor de la salud pública. El sistema de patentes imposibilita una auténtica competencia. Eso nadie lo dice. Sí permite la competencia, pero conforme a unas reglas que no favorecen el bien común.
¿ QUÉ OCURRE EN LOS PAÍSES SUBDESARROLLADOS ?
El sistema de patentes es singularmente injusto con los países subdesarrollados, que deben dar respuesta a situaciones sociales y económicas muy complejas y deberían estar exentos de las obligaciones ligadas a la propiedad intelectual internacional, especialmente en el caso de ciertos medicamentos. Ello no sólo no es un mito sino que se trata de una urgencia sanitaria de primera magnitud. Debe instaurarse un forum internacional en el que EEUU no posea derecho de veto. Los tratados internacionales sobre la protección mediante patentes impiden el ejercicio del derecho humano fundamental a disponer de los medicamentos que pueden salvar la vida. Como hemos visto, hay casos en que esto es cierto. Es preciso un nuevo sistema de patentes.
El abuso del actual sistema de explotación de patentes no afecta sólo a los países del Tercer Mundo. En los países ricos, cada vez hay más gente que tiene dificultades para pagar el precio de los tratamientos prescritos. Estas personas tienen que hacer equilibrios entre las facturas de alimentación o de calefacción y las de los medicamentos. Para reducir gastos, hay quien toma sus medicamentos día sí día no, y quien los comparte con otros miembros de la familia. En EEUU no es raro que el precio de tomar un medicamento durante un año sea de 1.500 dólares. Las personas de más de 65 años toman en este país (y cada vez más también en el nuestro) una media de 6 medicamentos. Ello representa un gasto de 9.000 dólares al año.
INVESTIGACIÓN EN FUNCIÓN DEL BENEFICIO ECONÓMICO POTENCIAL. Estudio de Teresa Forcades.
En 2001, el grupo de Médicos sin Fronteras (MSF) para el estudio de las enfermedades olvidadas publicó un informe titulado Desequilibrio fatal que impactó a la opinión pública. MSF montó una exposición itinerante para dar a conocer mejor los resultados de su investigación. El informe concluyó que las enfermedades que afectan principalmente a los pobres no tienen demasiadas opciones terapéuticas disponibles y casi no se investigan, a pesar de que afecten de forma grave o mortal a millones de personas y sean potencialmente curables.
Las enfermedades que afectan principalmente a los pobres se investigan poco y las enfermedades que afectan sólo a los pobres no se investigan nada. Algunas de estas últimas no tienen opción terapéutica alguna, como la fase crónica de la enfermedad de Chagas, una infección que afecta a millones de personas en Latinoamérica. El título del informe, Desequilibrio fatal, se refiere al hecho de que sólo el 10% de la investigación sanitaria mundial (la de las compañías farmacéuticas más la de todos los gobiernos y universidades del mundo) está dedicada a enfermedades que afectan al 90% de los enfermos del mundo.
Es conocido el escandaloso desequilibro de riqueza de nuestro mundo, donde el 20% de la población mundial disfruta y malgasta el 80% de la riqueza del planeta, y el 80% de la población malvive y muere con el 20% restante de los recursos. Podría pensarse que en el ámbito de las enfermedades el desequilibrio podría corregirse en parte porque es un tema que despierta la compasión y las ganas de ayudar, y donde hay muchas organizaciones internacionales implicadas. Pues bien, el desequilibro entre pobres y ricos propio de nuestro mundo no sólo no se reduce en cuanto a la disponibilidad de medicamentos, sino que resulta mucho peor. El 90% de los recursos sanitarios son dedicados a investigar las enfermedades que afectan al 10% de los enfermos (los del Primer Mundo), y sólo un 10% de los recursos se dedican a investigar las enfermedades que afectan al 90% de los enfermos. Este dato se conoce como “desequilibrio 10/90”.
LAS ENFERMEDADES TROPÍCALES SON ENFERMEDADES OLVIDADAS. Estudio de Teresa Forcades.
 |
Hasta hace muy poco, los pacientes que sufrían la enfermedad del sueño sólo tenían una opción terapéutica, muy dolorosa y altamente tóxica, porque el medicamento contenía arsénico. Para los que sufren de forma crónica la enfermedad de Chagas, no existe aún tratamiento (la enfermedad sólo se da en Latinoamérica y recibe el nombre del médico brasileño que la describió por primera vez en 1909). El agente causal es un parásito trasmitido por insectos que pican a las personas y les inoculan la infección. La fase aguda tiene una mortalidad muy alta, sobre todo en niños, y la fase crónica tiene un 32% de mortalidad por las lesiones cardiacas y digestivas ocasionadas por la multiplicación del parásito. Se estima que unos 20 millones de personas sufren dicha enfermedad. Los autores del informe de MSF, en colaboración con la Escuela de Salud Pública de Harvard, enviaron un cuestionario a las 20 compañías farmacéuticas más importantes del mundo solicitándoles información sobre sus programas de investigación. Sólo 11 empresas respondieron; entre ellas, 6 de las 10 más importantes. Como hemos visto, estas compañías son gigantes empresariales con miles de millones de beneficios anuales. De estas 11 empresas, no había ninguna que investigara la enfermedad del sueño y sólo 3 invirtieron algo en una de las otras dos enfermedades más olvidadas del mundo: la enfermedad de Chagas y la leishmaniasis.
Del total de 1.393 medicamentos comercializados entre 1975 y 1999, sólo 13 (1%) estaban destinados al tratamiento de una enfermedad tropical. Las enfermedades olvidadas incluyen: la malaria, la tuberculosis, la enfermedad del suelo (tripanosomiasis africana), la enfermedad de Chagas (tripanosomiasis sudamericana), la úlcera de Buruli, el dengue, la leishmaniasis, la lepra, la filariasis y la esquistosomiasis. Excepto las dos primeras. “Fatal Imbalance” MSF, p.10 ras, todas estas enfermedades afectan casi exclusivamente a los pobres.
Se puede objetar que las empresas privadas tienen derecho a invertir su dinero allá donde les plazca, pero resulta que el dinero que financia las investigaciones no es sólo privado, sino que en 6 de las 11 compañías procedían de convenios con la sanidad pública. Es decir, que el público en general pagamos dos veces por el mismo producto y, además, no tenemos control democrático sobre las prioridades con que se gasta dicho dinero. Pagamos primero para financiar las investigaciones y después para adquirir el producto. ¡Así no es de extrañar el nivel de beneficios!
De los 17 ensayos clínicos que validaron los 5 medicamentos más vendidos durante el año1995 (Zantac, Zovirax, Capoten, Vasotec y Prozac), sólo 1 había sido financiado por la industria farmacéutica. Del conjunto de estudios que fueron relevantes para llegar a desarrollar estos cinco medicamentos, sólo un 15% fueron financiados por la industria farmacéutica; el 55% del trabajo de investigación provino de NIH (institución pública que depende del gobierno de EEUU y es financiada a través de los impuestos) y el 30% restante, de instituciones académicas de fuera de EEUU, financiadas en su mayoría también con dinero público.
Un estudio de The Boston Globe sobre los 50 medicamentos más vendidos del 1992 al 1997 demostró que 45 habían recibido financiación pública. Los investigadores de MSF dejan claro que no son sólo los laboratorios los responsables del desequilibrio fatal, sino todas las instituciones públicas y privadas que colaboran para que la producción de medicamentos se oriente de forma exclusiva a la ganancia económica y se menosprecie el sufrimiento de los enfermos.
Si, como hemos visto, las enfermedades más estudiadas no son las enfermedades más graves que afectan a la humanidad, ¿cuales son, pues? Según el mismo informe de MSF, en 2001 la mayor parte de los esfuerzos financieros e intelectuales de la investigación sanitaria de todo el mundo fueron destinados a investigar la impotencia, la obesidad y el insomnio. Además de no ser tenidos en cuenta cuando de trata de decidir las prioridades de la investigación de nuevos medicamentos, los enfermos de los países pobres –especialmente los africanos– son utilizados como cobayas para obtener informaciones sanitarias varias que después rentabilizarán sin que ningún porcentaje de los beneficios obtenidos retorne a aquéllos que quizás han pagado con su vida. En Kenya, por ejemplo, y bajo la responsabilidad de la Universidad de Washington, se realizaron, a finales de la década de los noventa, estudios clínicos para observar la evolución natural de la enfermedad del SIDA. Lo que significa que, con la excusa de que hubieran muerto igualmente, se sometió a centenas de africanos a pruebas complementarias para analizar cómo iban deteriorándose hasta la muerte a medida que avanzaba la infección sin ofrecerles en ningún momento el tratamiento que podría haberla detenido.
En 2000, David Rothman, en el estudio "La vergüenza de la investigación médica", demostró que en 15 de los 16 ensayos clínicos que se llevaban a cabo en países en vías de desarrollo para estudiar un método más económico de prevenir la trasmisión del virus del SIDA durante el embarazo, las mujeres de los grupos de control recibieron un placebo (una pastilla de azúcar) en vez del tratamiento con AZT que está demostrado que evita la trasmisión maternofetal del virus. Según la convención de Helsinki para los protocolos éticos de la investigación médica, lo que debería haberse hecho habría sido comparar la nueva alternativa terapéutica con el tratamiento más eficaz de todos los existentes. Esto es lo que hizo la Escuela de Salud Pública de Harvard en su estudio en Tailandia. Fueron los únicos que lo hicieron así. El resto de los estudios –que reclutaron a un total de 17.000 mujeres– permitieron que la mitad de dichas mujeres se sometieran a las extracciones de sangre y las pruebas complementarias requeridas en los protocolos de estudio y tomaran diariamente una pastilla que era de azúcar y no servía para nada mientras su salud iba empeorando por falta de tratamiento y el virus iba infectando a los hijos que llevaban en su vientre.
Puedes seguir leyendo el resto del estudio en este Documento de Teresa Forcades: Los crímenes de las Farmacéuticas.
CASO 15 / 15.08.2021
MÁS DE 300.000 MUJERES FUERON ESTERILIZADAS EN PERÚ CONTRA SU VOLUNTAD
Durante el Gobierno de Fugi Muri, más de 300.000 mujeres fueron obligadas a esterilizarse mediante una vacuna.
CASO 16 / 15.08.2021
LA COMPAÑÍA LÍDER EN DIALÍSIS QUE SOBORNÓ A MÉDICOS ESPAÑOLES
ADMITIDA LA DEMANDA CONTRA SANOFI POR GRAVES DAÑOS FÍSICOS A BEBÉS
El Depakine causa autismo, problemas en el páncreas, el paladar y diversas malformaciones.Pese a ello, unas 10.000 embarazadas tomaron esa medicina entre 2007 y 2014, por lo que puede haber "miles de afectados", según un informe de la Agencia del Medicamento revelado por "Le Canard Enchainé".
Difíciles de calcular pues el Dépakine está en el mercado desde 1967, aunque las autoridades sanitarias no pueden saber antes de 2007 cuántas embarazadas lo tomaron.






















Comentarios